 |
| Wzór ogólny ketonów. |
Ketony - jest to grupa związków organicznych zawierających grupę ketonową, tj. grupę karbonylową (C=O) połączoną z dwoma atomami węgla. Proste ketony, będące monokarbonylowymi pochodnymi alkanów, noszą nazwę alkanonów i mają wzór ogólny CnH2n+2CO. Pokrewne związki, w których przy grupie karbonylowej znajduje się jeden lub dwa atomy wodoru, to aldehydy.
Ketony z niewielkimi grupami alkilowymi są cieczami, które dobrze mieszają się zarówno z wodą, jak i z rozpuszczalnikami organicznymi. Ketony są związkami umiarkowanie polarnymi i jednocześnie stosunkowo niereaktywnymi, dlatego są często stosowane jako rozpuszczalniki i dodatki do zmywaczy farb.


Otrzymywanie:
- w przemyśle z alkoholi II-rzędowych, przez katalityczne:
- odwodornienie za pomocą rozżarzonej miedzi
- utlenienie za pomocą powietrza
- utlenianie alkoholi II-rzęowych, np. za pomocą dichromianu:
-
- R
1R
2CHOH + Cr
2O2+
7 → R
1R
2C=O + Cr3+
- R
- addycja wody do alkinów (z wyjątkiem acetylenu)
- ketony aromatyczne w wyniku acylowania Friedla-Craftsa
- w wyniku reakcji związków kadmoorganicznych z chlorkami kwasowymi
Reakcje ketonów:
1) Addycja nukleofilowa:
Najbardziej charakterystycznymi reakcjami dla ketonów są reakcje addycji nukleofilowej do grupy karbonylowej, w wyniku której może nastąpić przyłączenie cząsteczki alkoholu, cyjanowodoru, hydrazyny, hydroksyloaminy, fenylohydrazyny, semikarbazydu, wodorosiarczynu sodu, a także może następować przyłączenie drugiej cząsteczki ketonu. Ketony są mniej reaktywne od aldehydów i reakcje addycji do ich grupy karbonylowej wymagają ostrzejszych warunków.
Centrum reakcji addycji nukleofilowej stanowi grupa karbonylowa. Jest to spowodowane tym, że ma ona płaski kształt (atom węgla wchodzący w jej skład posiada hybrydyzację sp2), dzięki czemu usunięta zostaje zawada steryczna. Ponadto silnie elektroujemnyatom tlenu jest w stanie przyjmować ładunek ujemny. Elektroujemność tlenu wpływa także na zwiększenie kwasowościwodorów α. W wyniku ataku nukleofilowej cząstki na elektrony πwiązania węgiel-tlen następuje jej przyłączenie do węgla grupy karbonylowej:[2]
- W wyniku ataku grupy cyjankowej CN- powstaje cyjanohydryna
- Wodorosiarczyn sodu przyłącza się, tworząc połączenie bisulfitowe, np.:

- Pochodne amoniaku (np. hydrazyna, hydroksyloamina, fenylohydrazyna, semikarbazyd) mogą przyłączać się do ketonu. Powstają wówczas odpowiednio: hydrazony, oksymy, fenylohydrazony oraz semikarbazony
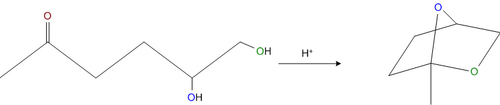
- Alkohole w środowisku kwasowym ulegają addycji do ketonu, tworząc hemiacetale lub acetale, dawniej zwane ketalami. W niektórych przypadkach reakcja ta może zajść wewnątrzcząsteczkowo, o ile dany keton posiada dwie grupy hydroksylowe - wtedy powstają bicykliczne wewnątrzcząsteczkowe acetale, np.:

Innym przykładem takiej reakcji wewnątrzcząsteczkowej jest zamykanie cząsteczki cukru. Podczas wytworzenia acetalu następuje usunięcie karbonylowego atomu tlenu z cząsteczki - oba obecne w niej atomy tlenu pochodzą z alkoholu.
2) Reakcje utleniania i redukcji:
Ketony bardzo trudno ulegają reakcjom utleniania i do ich zajścia wymagana jest wysoka temperatura, a w ich wyniku następuje rozerwanie wiązania węgiel-węgiel. Takiej reakcji z silnymi utleniaczami, np. KMnO4 czy K2Cr2O7 ulegają w rzeczywistości nietrwałe formy enolowe, pozostające w stanie równowagi z ketonem. Dlatego w wyniku takiego utleniania powstają złożone mieszaniny kwasów karboksylowych.
Ketony zawierające w pozycji α grupę hydroksylową lub karbonylową ulegają reakcji z kwasem nadjodowym i jego solami (np. NaIO4). Wtedy także następuje rozerwanie wiązania węgiel-węgiel i powstaje mieszanina kwasów karboksylowych i aldehydów, np.:

Ketony metylowe ulegają utlenianiu w wyniku reakcji haloformowej. Jest to reakcja z solami kwasów: podchlorawego, podbromawego lub podjodawego. Powstaje wtedy odpowiedni haloform (chloroform, bromoform lub jodoform) oraz sól kwasu karboksylowego:
RCOCH3 + 3NaOX → RCOONa + CHX3 + 2NaOH

Ketony można także utlenić za pomocą nadtlenku wodoru, kwasu nadmrówkowego, kwasu nadtlenobenzoesowego, kwasu metanadchlorobenzoesowego (czyli mCPBA) albo kwasu nadoctowego. W środowisku lekko kwasowym lub lekko zasadowym zachodzi wtedy utlenianie Baeyera-Villigera, które prowadzi do otrzymania estru. W przypadku utleniania ketonu cyklicznego produktem reakcji jest lakton.
Ketony można zredukować do alkoholi drugorzędowych na drodze hydrogenacji na katalizatorze palladowym lub niklowym. Czasami stosuje się jednak łagodniejsze reduktory (glinowodorek litu albo tetraboran sodu), ponieważ związki te nie redukują podwójnych wiązań węgiel-węgiel.
Redukcja Clemmensena prowadzi do otrzymania węglowodoru bezpośrednio z ketonu. Reduktorem tej reakcji jest amalgamat cynku w stężonym kwasie solnym.
(...)
Bezpośrednia redukcja do węglowodoru następuje także w redukcji Wolffa-Kiżnera, czyli reakcji z hydrazyną w mocno zasadowym środowisku (zazwyczaj wodorotlenek potasu lub tert-butanolan potasu).
Dzięki identycznym produktom redukcji Clemmensena i Wolffa-Kiżnera można dobrać odpowiednią metodę redukcji w zależności od redukowanego ketonu, szczególnie jego odporności na środowisko kwasowe i zasadowe. Obie metody są często stosowane do otrzymywania węglowodorów aromatycznych jako kolejny etap po acylowaniu Friedla-Craftsa.
Nomenklatura
Nazwy systematyczne ketonów tworzy się przez dodanie do nazwy szkieletu węglowego końcówki -on wraz z lokantem. Można też podać nazwy obu podstawników przy węglu karbonylowym poprzedzone słowem keton, np.
- 2-pentanon, czyli keton metylowo-propylowy:

- 3-pentanon, czyli keton dietylowy:

Przykłady ketonów
- aceton – powszechnie stosowany jako rozpuszczalnik
- BMK – keton benzylowo-metylowy stosowany do produkcji amfetaminy
- benzochinon – który jest produktem utlenienia hydrochinonu stosowanego w fotografii do wywoływania filmów
- ketozy – węglowodany zawierające grupę ketonową
Inne przykłady ketonów:
Zagadnienia związane z ketonami:
















































































































































































































Brak komentarzy:
Prześlij komentarz