 Fenole - są to związki organiczne zawierające grupy hydroksylowe związane bezpośrednio z atomami węgla w pierścieniu aromatycznym (w przeciwieństwie do alkoholi aromatycznych, np. alkoholu benzylowego, w których grupa hydroksylowa przyłączona jest do alkilowego atomu węgla). Wykazują znacznie większą kwasowość niż alkohole i mogą tworzyć z mocnymi zasadami sole, fenolany. Najprostszym fenolem z jedną grupą hydroksylową jest fenol.
Fenole - są to związki organiczne zawierające grupy hydroksylowe związane bezpośrednio z atomami węgla w pierścieniu aromatycznym (w przeciwieństwie do alkoholi aromatycznych, np. alkoholu benzylowego, w których grupa hydroksylowa przyłączona jest do alkilowego atomu węgla). Wykazują znacznie większą kwasowość niż alkohole i mogą tworzyć z mocnymi zasadami sole, fenolany. Najprostszym fenolem z jedną grupą hydroksylową jest fenol. Wzór ogólny: ArOH, gdzie Ar – grupa arylowa, OH – grupa hydroksylowa
Właściwości chemiczne: Fenole wykazują odczyn lekko kwasowy w wyniku dysocjacji elektrolitycznej, w trakcie której rozpadają się na jon hydroniowy i fenolanowy. Reagują z aktywnymi metalami, zasadami i tlenkami zasadowymi z wytworzeniem soli – fenolanów, np.:
- ArOH + NaOH → ArONa + H2O
- 2ArOH + 2Na → 2ArONa + H2↑
-
- Ar–OH + HNO3 → O2N−Ar−OH + H2O
- Hydroliza chlorowcopochodnych arenów. Reakcję tę trzeba przeprowadzać w wysokich temperaturach, gdyż chlorowcopochodne arenów ulegają hydrolizie dużo trudniej niż chlorowcopochodne alkanów (podczas hydrolizy których powstają alkohole). W przemyśle stosuje się jednak inne techniki, które są charakterystyczne dla poszczególnych fenoli.
- Metoda kumenowa (z benzenu i prop-2-enu).
- Z wykorzystaniem reakcji Sandmeyera, w ciągu reakcji: ArH → ArNO2 → ArNH2 → [ArN≡N]+[HSO4]− → ArOH. Ostatni etap – hydrolizę soli diazoniowej – przeprowadza się w roztworze azotanu miedzi(II) w obecności Cu2O
- eugenol
- gwajakol
- hydrochinon
- pirogalol
- pirokatechina
- resweratrol
- rezorcyna
- tymol
- katalizowana hydroliza chlorobenzenu w podwyższonej temperaturze,
- stapianie kwasu benzenosulfonowego lub jego soli z wodorotlenkiem sodu lub potasu i zakwaszanie powstałych fenolanów.
- Acetarsolum (ang. Acetarsone) – City Chemical LLC; West Haven (USA)
- Acetarsolum (ang. Acetarsone) – City Chemical LLC; West Haven (USA)
Ulegają reakcji estryfikacji podobnie jak alkohole z wytworzeniem odpowiednich estrów arylowych (np. octan fenylu). Łatwo ulegają reakcji substytucji elektrofilowej w pozycjach orto i para (np. nitrowaniu i sulfonowaniu) dzięki silnej aktywacji pierścienia aromatycznego przez grupę hydroksylową, np.
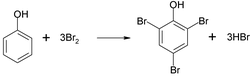
Szybko odbarwiają wodę bromową, np.:
Fenole są podatne na utlenianie. Na powietrzu tworzą barwne produkty utleniania i dimeryzacji oraz trimeryzacji.
hydrochinon → 1,4-benzochinon (katalizatorami mogą być dichromian sodu, kwas siarkowy)
Identyfikacja fenoli: Fenole identyfikuje się za pomocą soli żelaza (III) barwy pomarańczowej. W wyniku reakcji powstaje związek kompleksowy o barwie fioletowej (ciemnogranatowej).
Metody otrzymywania fenoli:
Przykłady fenoli:
Wiele fenoli i polifenoli występuje naturalnie, np.
Fenole jako środki dezynfekujące:
Po raz pierwszy zastosowane w 1865 r. Do oceny skuteczności i siły działania wyznacza się tzw. współczynnik fenolowy – oznaczający ile razy dany środek jest silniejszy/słabszy w porównaniu z czystym fenolem w odniesieniu do tego samego typu drobnoustrojów.
Mechanizm działania – polega na denaturacji białek bakteryjnych oraz inaktywacji niektórych enzymów niezbędnych w procesach życiowych.
Czas działania – do 24 godzin
Zastosowanie – jako środki konserwujące w preparatach farmaceutycznych oraz w dentystyce, gdzie nasączony związkiem jałowy wacik umieszcza się w komorze zęba. Działanie antyseptyczne uzyskuje się wówczas do głębokości 15 mm.
PRZYKŁADY FENOLI:
Otrzymywanie:
Najważniejszą metodą otrzymywania fenolu jest obecnie metoda kumenowa, ponadto otrzymuje się go przez utlenianie toluenu oraz w wyniku ekstrakcji ze smoły węglowej. Inne metody mają obecnie jedynie znaczenie historyczne; są to np.:
Światowa produkcja fenolu była szacowana na poziomie ok. 6,5 mln ton rocznie.
Właściwości: W temperaturze pokojowej czysty fenol jest bezbarwnym, krystalicznym ciałem stałym (pod wpływem powietrza i światła następuje częściowe utlenienie fenolu, w wyniku którego zmienia barwę na różową, brunatną lub czarną) o gęstości 1,07 g/cm³. Dobrze rozpuszcza się w rozpuszczalnikach organicznych i w wodnych roztworach mydeł (patrz lizol). W wodzie w temperaturze pokojowej rozpuszcza się umiarkowanie (w temp. 20 °C 8,2 g na 100 cm³ H2O), tworzy też roztwory wody w fenolu o stężeniu do ok. 28% (25 °C). Rozpuszczalność dla obu układów rośnie wraz z temperaturą i powyżej 68,8 °C obie substancje stają się mieszalne.
Wodne roztwory fenolu, w przeciwieństwie do obojętnych alkoholi, mają słabe właściwości kwasowe (stała dysocjacji Ka = 1,3·10−10). Fenol z mocnymi zasadami tworzy sole – fenolany. Jest to spowodowane efektem mezomerycznym stabilizującym anion fenolanowy C6H5O− dzięki delokalizacji ładunku ujemnego na pierścieniu aromatycznym fenolu:

Historia: Po raz pierwszy został wydzielony ze smoły węglowej w 1832 r. przez chemika niemieckiego Friedliba Rungego. Rok później został nazwany fenolem przez Frédérica Gerhardta. W 1867 r. sir Joseph Lister stwierdził jego właściwości odkażające.
Zastosowanie fenolu: Najważniejsze zastosowania fenolu to produkcja żywic fenolowo-formaldehydowych(np. bakelitu), leków (np. kwasu acetylosalicylowego), detergentów, herbicydów, fungicydów i barwników. Sam fenol był używany w roztworze wodnym jako środek bakteriobójczy (zobacz też lizol). Wodny roztwór fenolu, karbol, używany był do dezynfekcji pomieszczeń. Nazwa karbol była dawniej niekiedy stosowana również na określenie samego fenolu.
Zastosowanie w medycynie: Był jednym z najwcześniej stosowanych środków przeciwbakteryjnych. W stężeniu 0,2% działa bakteriostatycznie, 1,3% grzybobójczo, powyżej 1% bakteriobójczo. Na salach operacyjnych stosowano urządzenia rozpylające fenol (karbol) w postaci mgły w celach antyseptycznych.
Współcześnie fenol (FP IX: Phenolum) oraz tzw. fenol płynny (FP IV: Phenolum liquefactum) ze względu na dużą toksyczność jest w lecznictwie wykorzystywany w ograniczonym zakresie. Ma bardzo niewielkie zastosowanie w dermatologii, w leczeniu niektórych chorób skóry w różnych zakresach stężeń (dawniej stężenia 0,2–0,5%; Farmakopea Polska zaleca, aby maksymalne stężenie nie przekraczało 0,1%, choć np. maść Posterisan forte zawiera go 0,3%) oraz niekiedy jeszcze w stomatologii – w postaci płynnej pomocniczo jako antyseptyk w leczeniu endodontycznym (kanałowym) miazgi zębowej. W Polsce są dopuszczone do obrotu preparaty zawierające nawet do 4% fenolu (np. w preparacie Pigmentum Castellani). W stomatologii częściej od fenolu, choć także coraz rzadziej, stosowany jest eutektyk fenolu z kamforą – kamfenol.
Zagrożenia: Fenol jest związkiem toksycznym. Działa bardzo niszcząco na błony śluzowe i drogi oddechowe. Może doprowadzić do obrzęku krtani, oskrzeli i płuc oraz do martwicy jamy ustnej i przewodu pokarmowego. Podobnie jak inne substancje żrące dostępne w gospodarstwach domowych, bywa przyczyną zatruć i oparzeń, zarówno przypadkowych, jak i dokonywanych w celach samobójczych. Podczas II wojny światowej więźniów niektórych niemieckich obozów koncentracyjnych (np. Auschwitz-Birkenau, Buchenwald i Dachau) zabijano przez wstrzyknięcie fenolu bezpośrednio do komory serca. Tak zginęli między innymi: o. Maksymilian Kolbe, bp Michał Kozal i ks. Alojzy Andricki.
Preparaty
4) Alkohol sinapinylowy - jest to organiczny związek chemiczny z grupy alkoholi fenolowych. Jest składnikiem ligniny.
5) Aluminon - jest to organiczny związek chemiczny, sól amonowa kwasu aurynotrikarboksylowego, barwnik triarylometanowy.
(...) Stosowany jest do wykrywania i oznaczania metodą kolorymetryczną glinu w wodzie, żywności i tkankach. Tworzy intensywnie zabarwione laki z glinem, chromem, żelazem i berylem. Ma także zastosowanie w sprayach do gardła w aerozolu. Aluminon może być otrzymywany poprzez reakcję azotynu sodu z kwasem salicylowym, dodając formaldehyd, a następnie amoniak.
 6) p-Aminofenol (para-aminofenol, 4-aminofenol) - jest to organiczny związek chemiczny z grupy fenoli zawierający aminową grupę funkcyjną (-NH2). 4-Aminofenol najbardziej znany jest jako podstawowy składnik wywoływacza Rodinal w fotografii czarno-białej. W farmaceutyce używany do syntezy fenacetyny lub do produkcji paracetamolu (reakcja z bezwodnikiem octowym). Ma też zastosowania w przemyśle tekstowym, gumowym i jako półprodukt do syntezy barwników siarkowych i azotowych.
6) p-Aminofenol (para-aminofenol, 4-aminofenol) - jest to organiczny związek chemiczny z grupy fenoli zawierający aminową grupę funkcyjną (-NH2). 4-Aminofenol najbardziej znany jest jako podstawowy składnik wywoływacza Rodinal w fotografii czarno-białej. W farmaceutyce używany do syntezy fenacetyny lub do produkcji paracetamolu (reakcja z bezwodnikiem octowym). Ma też zastosowania w przemyśle tekstowym, gumowym i jako półprodukt do syntezy barwników siarkowych i azotowych.
p-Aminofenol to substancja higroskopijna, podatna na działanie temperatury, światła, powietrza, wilgoci, środków utleniających i żelaza.
(...) p-Aminofenol ma też zastosowania w przemyśle tekstowym, gumowym i jako półprodukt do syntezy barwników siarkowych i azotowych. p-Aminofenol to substancja higroskopijna, podatna na działanie temperatury, światła, powietrza, wilgoci, środków utleniających i żelaza.
p-Aminofenol powstaje podczas hydrolizy N-acetylo-p-aminofenolu (reakcja ta jest także pierwszym etapem metabolizmu paracetamolu w organizmach). Można go również otrzymać w wyniku redukcji p-nitrofenolu za pomocą borowodorku sodu.
p-Aminofenol jest jednym z trzech możliwych izomerów, pozostałe to 2-aminofenol (izomer orto) i 3-aminofenol (izomer meta).
Preparaty
 8) Aldehyd salicylowy (Saligenina) - jest to organiczny związek chemiczny będący zarówno alkoholem, jak i fenolem. Tworzy bezbarwne płytki rozpuszczalne w wodzie, alkoholu, benzenie, eterze i glikolu propylenowym. Występuje w korze wierzb (Salix), topoli i w roślinie wiązówce błotnej (Spirea ulmaria) w postaci glikozydu zwanego salicyną (saligenina jest aglikonem salicyny czyli w połączeniu z glukozą tworzy salicynę). Otrzymywany przez hydrolizę salicyny lub syntetycznie z fenolu i formaldehydu. Stosowany w lecznictwie jako lek przeciwgorączkowy i środek przeciwbólowy. Saligenina w organizmie w wyniku hydrolizy enzymatycznej pod wpływem enzymu salicynazy zostaje utleniona do kwasu salicylowego.
8) Aldehyd salicylowy (Saligenina) - jest to organiczny związek chemiczny będący zarówno alkoholem, jak i fenolem. Tworzy bezbarwne płytki rozpuszczalne w wodzie, alkoholu, benzenie, eterze i glikolu propylenowym. Występuje w korze wierzb (Salix), topoli i w roślinie wiązówce błotnej (Spirea ulmaria) w postaci glikozydu zwanego salicyną (saligenina jest aglikonem salicyny czyli w połączeniu z glukozą tworzy salicynę). Otrzymywany przez hydrolizę salicyny lub syntetycznie z fenolu i formaldehydu. Stosowany w lecznictwie jako lek przeciwgorączkowy i środek przeciwbólowy. Saligenina w organizmie w wyniku hydrolizy enzymatycznej pod wpływem enzymu salicynazy zostaje utleniona do kwasu salicylowego. Odniesienia w literaturze
Bohater powieści Nagi lunch Williama S. Burroughsa, doktor Benway, używa bulbokapniny by uzyskać posłuszeństwo torturowanych przez siebie ofiar.
--> Kwasy fenolowe:
-->Naftole:
-->Polifenole:
a) Antrachinony:
b) Antracykliny:
c) Galusany:
--> Salicylany:
*Salicylany – grupa organicznych związków chemicznych – soli i estrów kwasu salicylowego – o wzorze ogólnym C
6H
4(OH)COOR. Niektóre salicylany stosowane są w lecznictwie (np. salicylan fenylu, salicylan sodu) lub jako substancje zapachowe (np. salicylan benzylu, salicylan izobutylu).
6H
4(OH)COOR. Niektóre salicylany stosowane są w lecznictwie (np. salicylan fenylu, salicylan sodu) lub jako substancje zapachowe (np. salicylan benzylu, salicylan izobutylu).
a) Estry kwasu salicylowego:











































































































































































































































































































































































































































































































































Brak komentarzy:
Prześlij komentarz